تعيين رتبة التفاعل لتفاعل يشتمل على مادة متفاعلة واحدة
مثال:
الجدول التالي يمثل تغير التركيز للتفاعل : 2N2O5(g) → 4NO2(g) + O2(g) في تجربتين مختلفتين.
|
رقم التجربة |
تركيز N2O5 الابتدائي ( مول / لتر) |
السرعة الابتدائية لتحلل N2O5 ( مول / لتر . ث ) |
|
1 |
0,6 |
3 × 6-10 |
|
2 |
1,2 |
6 × 6-10 |
- اكتب الصيغة العامة لقانون السرعة.
- احسب رتبة التفاعل.
- اكتب قانون السرعة.
- احسب قيمة ثابت سرعة التفاعل k .
- احسب سرعة تفكك N2O5 عندما يكون تركيزه 1,5 × 10-3 مول/لتر.
- إذا تضاعف [N2O5] أربع مرات، فكم تتضاعف سرعة التفاعل؟
- هل هنالك علاقة بين معامل المادة المتفاعلة في المعادلة الكيميائية الموزونة ورتبة تلك المادة في قانون السرعة؟
الحل:
1. الصيغة العامة لقانون سرعة التفاعل هي:
سرعة التفاعل = [N2O5] kx
2. هنالك طريقتان لحساب رتبة التفاعل:
الطريقة الأولى : من ملاحظة العلاقة بين التركيز وسرعة التفاعل.
لاحظ من الجدول أن تضاعف تركيز N2O5 مرتان أدى إلى تضاعف السرعة مرتين، فالتفاعل في هذه الحالة من الرتبة الأولى.
الطريقة الثانية : نقسم التجربة رقم (2) على التجربة رقم (1):

وباختصار قيمة ثابت السرعة k لأنه ثابت تصبح العلاقة:

وبتعويض قيم السرعة والتركيز نجد أن:
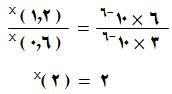
ويتحقق ذلك إذا كانت x = 1 ، ويوصف التفاعل في هذه الحالة بأنه أحادي الرتبة.
3. يكتب قانون السرعة بعد تحديد قيمة الرتبة على النحو التالي:
سرعة التفاعل = [N2O5] k1
4. لحساب ثابت سرعة التفاعل k نعوض التركيز والسرعة لأي من التجربتين الواردتين في الجدول في قانون السرعة، فمثلاً يمكن تعويض القيم الخاصة بالتجربة الأولى على النحو التالي:
سرعة التفاعل = [N2O5] k1
وبإعادة ترتيب العلاقة السابقة نحصل على:

5. نعوض التركيز المعطى في السؤال في قانون السرعة على النحو التالي:
سرعة التفاعل = [N2O5] k1
= 0,5 × 5-10 ( 1,5 × 3-10 )1
= 0,75 × 8-10 مول/لتر . ث
6. بما أن التفاعل من الرتبة الأولى، لذا فإن مضاعفة [N2O5] (4) مرات سيضاعف سرعة التفاعل أربع مرات.
7. لا يوجد علاقة، فرتبة التفاعل تعبر عن العلاقة بين تضاعف التركيز وتضاعف السرعة وتقاس بالتجربة العملية، أما المعامل فيعبر عن عدد المولات فقط.
سؤال 1 :
الجدول التالي يمثل تغير التركيز للتفاعل:
2A → B + 3C
|
رقم التجربة |
تركيز A ( مول / لتر ) |
سرعة استهلاك A ( مول/لتر . ثانية ) |
|
1 |
0,01 |
2 × 3-10 |
|
2 |
0,02 |
8 × 3-10 |
|
3 |
0,04 |
32 × 3-10 |
- اكتب القانون العام لسرعة التفاعل.
- احسب رتبة التفاعل السابق.
- اكتب قانون سرعة التفاعل.
- احسب قيمة ثابت السرعة k مع ذكر وحدته.
- احسب سرعة التفاعل عندما يكون [A] = 0,5 مول/لتر.
- كم تتضاعف سرعة التفاعل إذا تضاعف [A] 7 مرات؟
سؤال 2 :
في التفاعل الافتراضي الآتي : A → B . تم جمع البيانات في الجدول الآتي:
|
رقم التجربة |
[A] ( مول / لتر ) |
السرعة الابتدائية ( مول/لتر . ثانية ) |
|
1 |
0,2 |
1,6 × 9-10 |
|
2 |
0,4 |
6,4 × 9-10 |
|
3 |
0,6 |
1,44 × 8-10 |
أجب عن الأسئلة الآتية:
- ما رتبة التفاعل بالنسبة للمادة A ؟
- اكتب قانون سرعة التفاعل.
- احسب قيمة k .
- احسب سرعة التفاعل إذا كان [A] = 0,03 مول/لتر.
- ما وحدة k ؟
سؤال 3 :
في التفاعل العام الآتي: نواتج → 2A
إذا علمت أن قيمة ثابت السرعة k عند درجة حرارة معينة يساوي 1,5 × 10-4 ث-1.
- اكتب قانون سرعة التفاعل.
- احسب سرعة التفاعل عندما يكون = 0,1 مول/لتر.
إعداد : أ. أحمد الحسين
07 / 02 / 2019
النقاشات