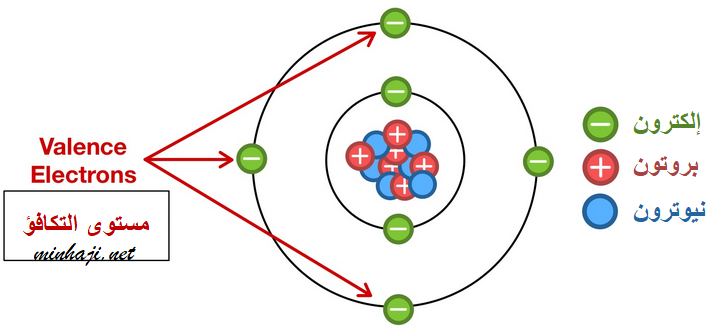
أزواج إلكترونات مستوى التكافؤ
تكوين الروابط
تتحدد نوع الرابطة التي تكونها الذرة عند ارتباطها بغيرها من الذرات بناءً على إلكترونات التكافؤ والموجودة في مستوى التكافؤ.
مستوى التكافؤ: المستوى الخارجي للذرة.
إلكترونات التكافؤ: الإلكترونات الموجودة في مستوى التكافؤ.
الرابطة التساهمية
تميل ذرات عناصر المجموعات الممثلة (7-4) لتكوين روابط تساهمية عند ارتباطها ببعضها، وتنشأ الرابطة التساهمية عندما تتشارك ذرتان بالإلكترونات.
الرابطة التساهمية: رابطة تنشأ عندما تتشارك ذرتين بزوج من الإلكترونات أو أكثر، ويكون زوج الإلكترونات منجذباً نحو نواتي الذرتين.
أزواج الإلكترونات الرابطة وغير الرابطة
تُسمى أزواج الإلكترونات المشتركة في تكوين الرابطة التساهمية أزواج الإلكترونات الرابطة، وتُسمى أزواج الإلكترونات التي لا تشارك في تكوين الروابط أزواج الإلكترونات غير الرابطة.
ولتوضيح كيف تتكون الرابطة التساهمية، وكيفية تحديد عدد أزواج الإلكترونات الرابطة وغير الرابطة لنأخذ مثالاً بسيطاً، وهو جزيء F2 (العدد الذري للفلور = 9).
أولاً: نحدد عدد إلكترونات التكافؤ لذرة الفلور:

ثانياً: نحدد عدد الإلكترونات المتوفرة (v.e) في مستوى التكافؤ في جزيء F2
عدد الإلكترونات المتوفرة (v.e) = عدد إلكترونات تكافؤ × عدد الذرات في الجزيء
عدد الإلكترونات المتوفرة (v.e) = 7 x 2 = 14 e
ثالثاً: نحسب عدد أزواج الإلكترونات المتوفرة (v.e.p) بقسمة عدد الإلكترونات على (2):
n(v.e.p) = 14 / 2 = 7
رابعاً: نرسم رابطة أحادية بين ذرتي الفلور، وتمثل الرابطة زوج رابط من الإلكترونات (b.e.p).

خامساً: نحسب عدد أزواج الإلكترونات المتبقية (l.e.p) وتساوي:
عدد أزواج الإلكترونات المتوفرة (v.e.p) – عدد أزواج الإلكترونات الرابطة (b.e.p)
n(l.e.p) = n(v.e.p) – n(b.e.p) = 7 – 1 = 6
سادساً: نوزع الأزواج المتبقية على ذرتي الفلور بحيث تحقق قاعدة الثمانية:

وتمثل الأزواج المتبقية الأزواج غير الرابطة من الإلكترونات.
لاحظ أن عدد أزواج الإلكترونات الرابطة بين ذرتي الفلور هو زوج واحد، وعدد أزواج الإلكترونات غير الرابطة على كل ذرة فلور تساوي (3) أزواج.
إعداد : أ. أحمد الحسين
16 / 09 / 2022
النقاشات