أسئلة المحتوى وإجاباتها
نظرية تنافر أزواج إلكترونات مستوى التكافؤ
أفكر صفحة (17):
أي الآتية يحتوي روابط تناسقية:
H2O, BeCl4-, H3O+, BeCl2
BeCl4-, H3O+
 أتحقق صفحة (17):
أتحقق صفحة (17):
أرسم تركيب لويس لكل من الجزيئات الآتية، وأحدد عدد أزواج الإلكترونات الرابطة وغير الرابطة حول ذرتها المركزية:
OF2 , BeH2
جزيء BeH2 :

عدد أزواج الإلكترونات الرابطة = 2
عدد أزواج الإلكترونات غير الرابطة في الذرة المركزية = 0
جزيء OF2 :

عدد أزواج الإلكترونات الرابطة = 2
عدد أزواج الإلكترونات غير الرابطة في الذرة المركزية = 2
 أتحقق صفحة (18):
أتحقق صفحة (18):
ما العلاقة بين عدد أزواج الإلكترونات حول الذرة المركزية ومقدار الزاوية بين الروابط في الجزي؟
بزيادة عدد أزواج الإلكترونات الرابطة حول الذرة المركزية تقل الزاوية بين الروابط.
أفكر صفحة (21):
يحقق الأكسجين في مركباته قاعدة الثمانية، فما الشكل المتوقع لجزيء الأوزون O3؟ وكيف تترتب أزواج الإلكترونات حول الذرة المركزية؟
8O: 1s2 2s2 2p4
عدد إلكترونات التكافؤ = 6
مجموع عدد إلكترونات التكافؤ = 3 × 6 = 18
عدد أزواج الإلكترونات = 9
يتخذ توزيع أزواج الإلكترونات حول ذرات الأكسجين أحد الشكلين الآتيين:
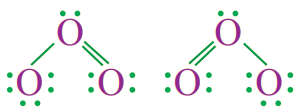
فيكون الشكل الفراغي لجزيء O3 منحنياً.
 أتحقق صفحة (21):
أتحقق صفحة (21):
أقارن بين الجزيئات الآتية من حيث الشكل الفراغي ومقدار الزاوية بين الروابط الآتية:
SiH4 , BF3 , BeH2
|
الجزيء |
الشكل الفراغي |
مقدار الزاوية بين الروابط |
|
BeH2 |
خطي |
180o |
|
BF3 |
مثلث مستوٍ |
120o |
|
SiH4 |
رباعي الأوجه منتظم |
104.5o |
إعداد : شبكة منهاجي التعليمية
23 / 07 / 2025
النقاشات