أسئلة وزارية (الحموض والقواعد)
الدورات (2001-2005)
الدورة التكميلية 2001
أ- انقل إلى دفتر إجابتك الإجابة الصحيحة لكل فقرة من الفقرات الثلاث الآتية:
1- في محلول مائي لـِ N2H4 تركيزه (0.01 M)، Kb لـِ N2H4 = 1 x 10-6، فإن قيمة pH للمحلول تساوي:
أ) 4
ب) 8
ج) 10
د) 12
2- أحد المحاليل الآتية المتساوية في التركيز له أقل قيمة pH :
أ) KCl
ب) NaCN
ج) NaNO3
د) NH4NO3
3- إحدى المواد الآتية تسلك كحمض لويس فقط:
أ) NH3
ب) B(OH)3
ج) OH-
د) H2O
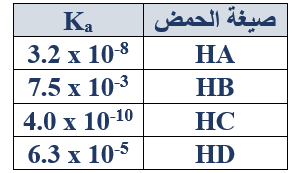 ب- اعتماداً على الجدول المجاور الذي يبيّن قيم ثابت التأين (Ka) لعدد من الحموض الضعيفة، أجب عما يأتي:
ب- اعتماداً على الجدول المجاور الذي يبيّن قيم ثابت التأين (Ka) لعدد من الحموض الضعيفة، أجب عما يأتي:
1- أي من محاليل هذه الحموض له أقل قيمة (pH)؟ (التركيز نفسه).
HB
2- حدد الزوجين المرافقين من الحمض والقاعدة عند تفاعل حمض HD مع الماء.
(HD/D-) , (H2O/H3O+)
3- أي من محاليل أملاح البوتاسيوم لهذه الحموض له أقل قيمة (pH)؟ (التركيز نفسه).
KB
4- احسب قيمة pH لمحلول الحمض HC تركيزه (0.25 M).
Ka = =
4 x 10-10 =
[H3O+] = = 1 x 10-5 M
pH = -log [H3O+] = -log (1 x 10-5) = 5
5- قرر الجهة التي يرجحها الاتزان في التفاعل الآتي:
HA(aq) + D-(aq) HD(aq) + A-(aq)
يرجح الاتزان جهة المتفاعلات (الاتجاه العكسي).
ج- حُضر محلول منظم من قاعدة ضعيفة (B) تركيزها (0.3 M) والملح (BHCl) بالتركيز نفسه، فإذا علمت أن Kb لـِ B = 2 x 10-4 ، أجب عما يأتي:
1- احسب pH للمحلول المنظم الناتج. (log 5 = 0.7 , log 2 = 0.3)
Kb =
2 x 10-4 =
[OH-] = 2 x 10-4 M
pOH = - log [OH-] = - log (2 x 10-4) = 4 - log 2 = 4 - 0.3 = 3.7
pH = 14 - 3.7 = 10.3
2- احسب كم تصبح قيمة pH عند إضافة 0.1 mol من HCl إلى لتر من المحلول المنظم السابق.
أحسب تركيز الحمض HCl :
M = = = 0.1 M
Kb =
2 x 10-4 =
2 x 10-4 =
[OH-] = 1 x 10-4 M
pOH = - log [OH-] = - log (1 x 10-4) = 4
pH = 14 - 4 = 10
دورة 2001
أ- انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لكل فقرة من الفقرات الآتية على الترتيب:
1- أحد محاليل الأملاح الآتية له تأثير قاعدي:
أ) KNO3
ب)KCN
ج)NH4NO3
د) KCl
2- محلول مائي لقاعدة ضعيفة B تركيزه (0.01 M) وكان Kb لها = 1.6 x 10-9،
(Kw = 1 x 10-14)؛ فإن [H3O+] في المحلول (M) يساوي:
أ) 4 x 10-5
ب) 4 x 10-6
ج) 2.5 x 10-9
د) 2.5 x 10-10
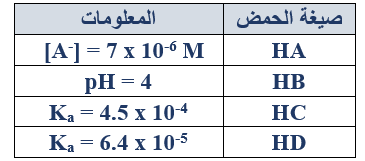 ب- لديك أربعة محاليل مائية لبعض الحموض الضعيفة بتراكيز متساوية (0.1 M) لكل منها. بالاعتماد على المعلومات الواردة عن كل حمض في الجدول المجاور، أجب عما يأتي:
ب- لديك أربعة محاليل مائية لبعض الحموض الضعيفة بتراكيز متساوية (0.1 M) لكل منها. بالاعتماد على المعلومات الواردة عن كل حمض في الجدول المجاور، أجب عما يأتي:
1- احسب قيمة Ka لكل من الحمضين: HA , HB.
الحمض: HA
Ka = =
Ka = = 49 x 10-11
الحمض: HB
[H3O+] = 10-pH = 10-4 = 1 x 10-4 M
Ka = =
Ka = = 1 x 10-7
2- أي القاعدتين المرافقتين أقوى:C- أم D- ؟
D-
3- اكتب معادلة تفاعل الحمض HC(aq) مع القاعدة NH3(aq) ، وفق تعريف برونستد - لوري، وحدد الزوجين المرافقين من الحمض والقاعدة في معادلة التفاعل نفسه.
NH3 + HC NH4+ + C-
الأزواج المترافقة: (NH3/NH4+) , (HC/C-)
4- ماذا يحدث لقيمة pH للحمض HB(aq) إذا خففنا التركيز إلى 0.05 M، (تقل، تبقى ثابتة، تزداد)؟
تزداد.
ج- تم تحضير محلول من الحمض H2CO3 والملح NaHCO3 بالتركيز نفسه، فإذا كان [H3O+] في المحلول = M 4 x 10-7،
ويتأين الحمض في الماء كما في المعادلة الآتية:
H2CO3(aq) + H2O(l) HCO3-(aq) + H3O+(aq) ، أجب عما يأتي:
1- احسب قيمة ثابت التأين Ka للحمض.
Ka =
Ka = = 4 x 10-7
2- اكتب صيغة الأيون المشترك.
HCO3-
3- احسب قيمة النسبة  لتصبح قيمة pH للمحلول تساوي 7.4 وهي القيمة المناسبة ليؤدي الدم وظيفته في الجسم. (علماً بأن log 4 = 0.6).
لتصبح قيمة pH للمحلول تساوي 7.4 وهي القيمة المناسبة ليؤدي الدم وظيفته في الجسم. (علماً بأن log 4 = 0.6).
[H3O+] = 10-pH = 10-7.4 = 4 x 10-8 M
Ka =
4 x 10-7 =
= = 10
= 0.1
الدورة الشتوية 2001
أ- انقل إلى دفتر إجابتك الإجابة الصحيحة في الفقرة الآتية:
إحدى الصيغ الآتية تسلك سلوك قاعدة فقط:
أ) HCOO-
ب) NH4+
ج) H2O
د) HCO3-
ب- اكتب معادلة تمثل التفاعل بين الأيون CN- والحمض HF .
HF + CN- F- + HCN
ج- إذا كانت قيمة pH لمحلول (0.01 M) من القاعدة (B) = 9 ، احسب قيمة Kb للقاعدة (B). (Kw = 1 x 10-14)
[H3O+] = 10-pH = 10-9 = 1 x 10-9 M
[OH-] = = = 1 x 10-5 M
Kb = =
Kb = = 1 x 10-8
د- 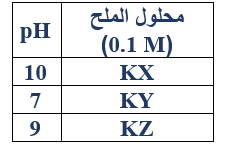 اعتماداً على الجدول المجاور الذي يبين قيمة pH لكل من محاليل الأملاح:
اعتماداً على الجدول المجاور الذي يبين قيمة pH لكل من محاليل الأملاح:
KZ , KY , KX (0.1 M) أجب عما يأتي:
1- رتب الحموض: HZ , HY , HX تصاعدياً حسب قوتها.
HY > HZ > HX
2- اكتب معادلة تفاعل (ـZ) مع الماء، ثم حدد الزوجين المرافقين من الحمض والقاعدة.
Z- + H2O HZ + OH-
3- بين ما يحدث لقيمة pH لمحلول الملح KY إذا خفف تركيزه إلى (0.01 M).
تبقى ثابتة؛ (لأن الملح متعادل لا يتأثر بالتخفيف).
هـ- تم تحضير محلول منظم من حمض CH3COOH تركيزه (0.2 M) والملح CH3COONa ، فكانت قيمة pH للمحلول المنظم = 5 ، فإذا علمت أن Ka لـ CH3COOH = 2 x 10-5 ، أجب عما يأتي:
1- اكتب صيغة الأيون المشترك.
CH3COO-
2- احسب تركيز CH3COONa في المحلول المنظم.
[H3O+] = 10-pH = 10-5 = 1 x 10-5 M
Ka =
2 x 10-5 =
[CH3COO-] = [CH3COONa] = 0.4 M
3- احسب [H3O+] في المحلول المنظم إذا أضيف إلى لتر واحد منه (0.1 mol) من حمض HCl .
أحسب تركيز الحمض HCl :
M = = = 0.1 M
Ka =
2 x 10-5 =
2 x 10-5 =
[H3O+] = 2 x 10-5 M
الدورة الصيفية 2002
أ- انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لكل من الفقرات الآتية على الترتيب:
1- إحدى المواد الآتية تعتبر قاعدة لويس:
أ) B(OH)3
ب) Zn2+
ج) HCl
د) NF3
2- المحلول الذي له أقل رقم هيدروجيني (pH) من بين المحاليل الآتية المتساوية في التركيز هو:
أ) KNO2
ب) NH4NO3
ج) NaCl
د) KCN
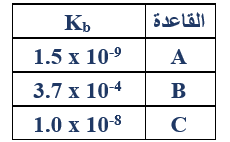 ب- يبين الجدول المجاور قيم Kb لمحاليل بعض القواعد الضعيفة المتساوية في التركيز. اعتماداً على الجدول أجب عما يأتي:
ب- يبين الجدول المجاور قيم Kb لمحاليل بعض القواعد الضعيفة المتساوية في التركيز. اعتماداً على الجدول أجب عما يأتي:
1- أي من محاليل القواعد له أقل قيمة (pH)؟
A
2- أي من محاليل القواعد يتفاعل بدرجة أكبر مع الماء؟
B
3- اكتب معادلة تفاعل القاعدة (A) مع الماء ثم حدد الزوجين المرافقين من الحمض والقاعدة.
A + H2O HA+ + OH-
الزوجين المترافقين: (A/HA+) , (H2O/OH-)
4- احسب (pH) في محلول تركيزه (0.01 M) من القاعدة C.
Kb = =
1 x 10-8 =
[OH-] = = 1 x 10-5 M
pOH = -log [OH-] = - log (1 x 10-5) = 5
pH = 14 - 5 = 9
5- رتب الحموض المرافقة للقواعد السابقة حسب تزايد قوتها.
HA+ > HC+ > HB+
ج- اكتب معادلة تمثل التأثير القاعدي لمحلول الملح Na2CO3 .
Na2CO3 2Na+ + CO32-
CO32- + H2O HCO3- + OH-
د-
1- في محلول HF تركيزه (0.1 M) كان تركيز [H3O+] = 8 x 10-3 M. احسب قيمة Ka لهذا الحمض.
Ka = =
Ka = = 64 x 10-4
2- إذا أضيف إلى لتر من المحلول السابق (0.64 mol) من ملح NaF ، احسب قيمة (pH) للمحلول الناتج. (أهمل التغير في حجم المحلول).
أحسب تركيز الملح NaF :
M = = = 0.64 M = [F-]
Ka =
64 x 10-4 =
[H3O+] = 1 x 10-6 M
pH = -log [H3O+] = - log (1 x 10-6) = 6
الدورة الشتوية 2003
أ- انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لكل فقرة من الفقرات الآتية على الترتيب:
1- المادة التي تسلك سلوكاً قاعدياً وفق مفهوم لويس:
أ) Ag+
ب) H2O
ج) B(OH)3
د) HCl
2- أحد المحاليل الآتية المتساوية في التركيز، له أعلى قيمة pH :
أ) KCl
ب) NH4NO3
ج) NaF
د) NH4Cl
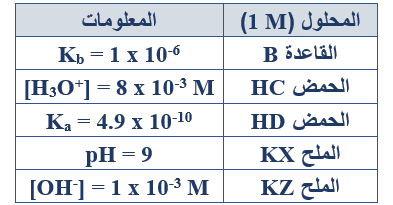 ب- في الجدول المجاور خمسة محاليل تركيز كل منها (1 M) وهي: (قاعدة ضعيفة، وحمضان ضعيفان، وملحان). اعتماداً على المعلومات الواردة عن كل منها في الجدول، أجب عما يأتي:
ب- في الجدول المجاور خمسة محاليل تركيز كل منها (1 M) وهي: (قاعدة ضعيفة، وحمضان ضعيفان، وملحان). اعتماداً على المعلومات الواردة عن كل منها في الجدول، أجب عما يأتي:
1- أيهما أضعف كقاعدة: C- أم D- ؟
C-
2- احسب قيمة pH للقاعدة B .
Kb = =
1 x 10-6 =
[OH-] = = 1 x 10-3 M
pOH = -log [OH-] = - log (1 x 10-3) = 3
pH = 14 - 3 = 11
3- أي الحمضين أقوى: HX أم HZ وضح إجابتك.
قيمة pH لمحلول الملح KX = 9، وقيمة pH لمحلول الملح KZ = 11، لذا فإن الحمض HX أقوى من الحمض HZ .
4- اكتب معادلة موزونة تمثل التفاعل بين محلول الحمض HD والأيون C- ، ثم:
HD + C- D- + HC
أ- بين أي الاتجاهين يرجح الاتزان.
يرجح الاتزان جهة المتفاعلات (الاتجاه العكسي).
ب- حدد الزوجين المترافقين من الحمض والقاعدة في التفاعل السابق.
(HD/D-) , (C-/HC)
5- احسب [H3O+] في محلول مكون من القاعدة B (1 M) والملح BHCl (0.5 M).
Kb =
1 x 10-6 =
[OH-] = 2 x 10-6 M
[H3O+] = = = 0.5 x 10-8 = 5 x 10-9 M
الدورة الصيفية 2003
أ- انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لكل فقرة من الفقرات الآتية:
1- الحمض المرافق لـ HPO42-(aq) هو:
أ) PO43-(aq)
ب) H2PO4-(aq)
ج) H3PO4(aq)
د) H3O+(aq)
2- إذا كانت محاليل الأملاح: NH4NO3 , NaHCO3 , NaNO3 متساوية في التركيز، فإن ترتيبها حسب تناقص قيم pH لمحاليلها هو:
أ) NH4NO3<NaNO3<NaHCO3
ب) NH4NO3<NaHCO3<NaNO3
ج)NaNO3<NaHCO3<NH4NO3
د) NaHCO3<NaNO3<NH4NO3
ب- فسر السلوك الحمضي لـ CH3COOH وفق مفهوم:
1- برونستد - لوري.
لأنه مانح للبروتون أثناء التفاعل.
2- لويس.
لأنه مستقبل لزوج من الإلكترونات.
ج- تم إذابة (0.015 mol) من قاعدة ضعيفة (B) في (500 mL) من الماء، فكانت قيمة pH للمحلول = 11 احسب قيمة Kb للقاعدة B .
أحسب تركيز القاعدة B :
M = = = 0.03 M
أحسب تركيز أيون الهيدرونيوم ثم الهيدروكسيد من قيمة pH :
[H3O+] = 10-pH = 10-11 = 1 x 10-11 M
[OH-] = = = 1 x 10-3 M
Kb = =
Kb = = 0.3 x 10-4
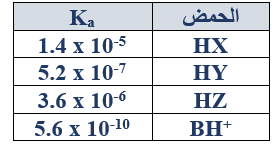 د- اعتمادا ًعلى الجدول المجاور الذي يبين قيم Ka لبعض الحموض الضعيفة المتساوية في التركيز.
د- اعتمادا ًعلى الجدول المجاور الذي يبين قيم Ka لبعض الحموض الضعيفة المتساوية في التركيز.
أجب عما يأتي:
1- أي القاعدتين المرافقتين: ( X- أم Z- ) أقوى؟
Z-
2- حدد الزوجين المترافقين من الحمض والقاعدة في التفاعل الآتي، ثم بين أي الاتجاهين يرجح الاتزان؟
HX(aq) + B(aq) BH+(aq) + X-(aq)
الزوجين المترافقين: (B/BH+) , (HX/X-)
يرجح الاتزان جهة النواتج (الاتجاه الأمامي).
3- أضيف (0.09 mol) من الملح KZ إلى (250 mL) من محلول الحمض HZ (0.1 M):
- احسب قيمة pH للمحلول الناتج.
أحسب تركيز الملح KZ :
M = = = 0.36 M
Ka =
3.6 x 10-6 =
[H3O+] = 1 x 10-6 M
pH = -log [H3O+] = - log (1 x 10-6) = 6
- ما الأيون المشترك في المحلول الناتج؟
Z-
الدورة الشتوية 2004
أ- انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لكل فقرة من الفقرات الآتية على الترتيب:
1- المادة التي تسلك سلوكاً حمضياً وفق مفهوم لويس هي:
أ) Cl-
ب) OH-
ج) NH3
د) Ag+
2- أحد محاليل المواد الآتية (تركيز كل منها 1 M) له أقل قيمة pH :
أ) Na2CO3
ب) NaBr
ج) NaHS
د) NaHCO3
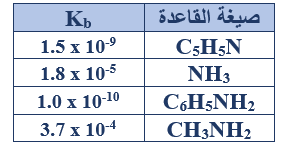 ب- اعتماداً على الجدول المجاور الذي يبين قيم ثابت التأين (Kb) لعدد من القواعد الضعيفة (تركيز كل منها 0.1 M). أجب عما يأتي:
ب- اعتماداً على الجدول المجاور الذي يبين قيم ثابت التأين (Kb) لعدد من القواعد الضعيفة (تركيز كل منها 0.1 M). أجب عما يأتي:
1- اكتب صيغة القاعدة الأقوى.
CH3NH2
2- اكتب معادلة تفاعل القاعدة (C5H5N) مع الماء، ثم حدد الزوجين المترافقين من الحمض والقاعدة في التفاعل.
C5H5N + H2O C5H5NH+ + OH-
الزوجين المترافقين: (C5H5N/C5H5NH+) , (H2O/OH-)
3- أي القواعد له أقل قيمة pH ؟
C6H5NH2
4- أكمل المعادلة الآتية ثم حدد أي الاتجاهين يرجح الاتزان:
C6H5NH2(aq) + NH4+(aq) ……… + …………
C6H5NH2(aq) + NH4+(aq) C6H5NH3+ + NH3
يرجح الاتزان جهة المتفاعلات (الاتجاه العكسي).
ج) إذا علمت أن Ka للحمض HOCl يساوي 2.8 x 10-8 وتركيزه (0.25 M) .
1- احسب [H3O+] في محلول الحمض.
Ka = =
2.8 x 10-8 =
[H3O+] = = = 0.83 x 10-4 M
2- احسب عدد مولات الملح NaOCl التي يجب إضافتها إلى (200 mL) من محلول الحمض لتصبح قيمة pH = 7.
[H3O+] = 10-pH = 10-7 = 1 x 10-7 M
Ka =
2.8 x 10-8 =
[OCl-] = [NaOCl] = 0.7 x 10-1 M
n = M x V = 0.7 x 10-1 x 0.2 = 0.014 mol
3- ما الأيون المشترك في المحلول الناتج بعد إضافة الملح؟
OCl-
الدورة الصيفية (ملغاة) 2004
أ- انقل إلى دفتر إجابتك الإجابة الصحيحة للفقرة الآتية:
إذا كان ترتيب القواعد حسب قوتها: Y- < A- < X- ، والحمض HZ أضعف من الحمض HX ، فإن الحمض الذي له ثابت تأين Ka أكبر هو:
أ) HA
ب) HX
ج) HY
د) HZ
ب- فسر ما يأتي:
1- لا يوجد البروتون (H+) منفرداً في الوسط المائي.
لأن حجمه صغير، وكثافة الشحنة عالية؛ لذا يرتبط بالماء برابطة تناسقية مكوناً أيون الهيدرونيوم.
2- يعد الأيون (Ni2+) حمضاً حسب مفهوم لويس.
لأن له القدرة على استقبال زوج غير رابط من الإلكترونات لاحتوائه على فلك فارغ.
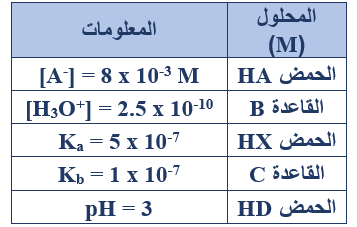 ج- في الجدول المجاور خمسة محاليل تركيز كل منها (1 M) اعتماداً على المعلومات الواردة عن كل منها في الجدول، أجب عما يأتي:
ج- في الجدول المجاور خمسة محاليل تركيز كل منها (1 M) اعتماداً على المعلومات الواردة عن كل منها في الجدول، أجب عما يأتي:
1- حدد أقوى حمض وأضعف حمض.
أقوى حمض: HA ، أضعف حمض: HX
2- احسب Kb للقاعدة B.
[H3O+] = 2.5 x 10-10 M
[OH-] = = = 0.4 x 10-4 = 4 x 10-5 M
Kb = =
Kb = = 16 x 10-10
3- أي القاعدتين أقوى: (B أم C)؟
C
4- أكمل التفاعل الآتي ثم بين أي الاتجاهين يرجح الاتزان:
HA + D- ………. + ……….
HA + D- A- + HD
يرجح الاتزان جهة النواتج (الاتجاه الأمامي).
5- ما أثر إضافة ملح NaX إلى محلول حمض HX على قيمة pH للحمض؟
تزداد من قيمة pH .
الدورة الصيفية 2004
أ- انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لها على الترتيب:
1- يعرّف الحمض حسب مفهوم برونستد - لوري على أنه مادة قادرة على:
أ) منح زوج إلكترونات أو أكثر.
ب) استقبال زوج إلكترونات أو أكثر.
ج) استقبال البروتون.
د) منح البروتون.
2- أي من المواد الآتية يسلك كحمض ويسلك كقاعدة؟
أ) NH4+
ب) HCOO-
ج) HCrO4-
د) CH3NH3+
ب- حدد الزوجين المترافقين من الحمض والقاعدة في التفاعل التالي:
NH2- + HCO3- CO32- + NH3
(NH2-/NH3) , (HCO3-/CO32-)
ج- حدد حمض وقاعدة لويس في التفاعل:
B(OH)3 + Cl- [B(OH)3Cl]-
حمض لويس: B(OH)3
قاعدة لويس: Cl-
د- ما طبيعة تأثير محلول كل من الملحين (حمضي، قاعدي، متعادل):
1- NH4I : حمضي.
2- KNO3 : متعادل.
هـ- إذا كانت قيمة pH لمحلول HCN تساوي (5)، احسب تركيز الحمض علماً بأن ثابت تأين الحمض (Ka) يساوي 5 x 10-10
[H3O+] = 10-pH = 10-5 = 1 x 10-5 M
Ka = =
5 x 10-10 =
[HCN] = 0.2 M
و- محلول مائي مكون من C6H5NH2 بتركيز (0.25 M) و C6H5NH3Br بتركيز (0.2 M)، قيست pH فكانت (4.7):
1- حدد الأيون المشترك.
C6H5NH3+
2- احسب Kb لـ C6H5NH2 .
(log 7 = 0.84 , log 4 = 0.6 , log 3 = 0.5 , log 2 = 0.3)
[H3O+] = 10-pH = 10-4.7 = 2 x 10-5 M
[OH-] = = = 0.5 x 10-9 = 5 x 10-10 M
Kb =
Kb = = 4 x 10-10
الدورة الشتوية 2005
أ- انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لكل فقرة من الفقرات الـ (2) الآتية:
1- أحد الآتية يعدّ قاعدة لويس:
أ) NH3
ب) HCl
ج) BF3
د) Cd2+
2- أحد محاليل الأملاح الآتية المتساوية في التركيز له أقل قيمة pH :
أ) NaCN
ب) NH4Cl
ج) CH3COONa
د) NaCl
ب- احسب قيمة Kb لقاعدة ضعيفة (B)، إذا علمت أن قيمة pH لمحلول تركيزه (0.25 M) من القاعدة يساوي 9
[H3O+] = 10-pH = 10-9 = 1 x 10-9 M
[OH-] = = = 1 x 10-5 M
Kb = =
Kb = = 4 x 10-10
ج- 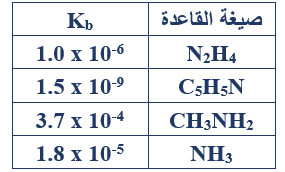 يبين الجدول المجاور ثابت التأين لبعض القواعد الضعيفة المتساوية في التركيز. اعتماداً على الجدول، أجب عما يأتي:
يبين الجدول المجاور ثابت التأين لبعض القواعد الضعيفة المتساوية في التركيز. اعتماداً على الجدول، أجب عما يأتي:
1- اكتب صيغة القاعدة التي محلولها له أقل قيمة pH .
C5H5N
2- ما القاعدة التي يكون حمضها المرافق هو الأضعف؟
CH3NH2
3- في التفاعل الآتي:
NH3 + C5H5NH+ NH4+ + C5H5N
أ- حدد الزوجين المترافقين من الحمض والقاعدة.
(NH3/NH4+) , (C5H5NH+/C5H5N)
ب- أي الاتجاهين يرجح الاتزان؟
يرجح الاتزان جهة النواتج (الاتجاه الأمامي).
4- إذا أضيف (0.18 mol) من ملح NH4Cl إلى لتر واحد من محلول تركيزه (0.01 M) من القاعدة NH3 :
أ- اكتب صيغة الأيون المشترك.
NH4+
ب- احسب قيمة pH للمحلول الناتج. (أهمل التغير في الحجم).
أحسب تركيز الملح NH4Cl :
M = = = 0.18 M
Kb =
1.8 x 10-5 =
[OH-] = 1 x 10-6 M
[H3O+] = = = 1 x 10-8 M
pH = - log [H3O+] = - log (1 x 10-8) = 8
ج- ما أثر إضافة الملح NH4Cl على قيمة pH لمحلول القاعدة NH3 ؟ (تبقى ثابتة، تزداد، تقل)
تقل.
الدورة الصيفية 2005
أ- انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لكل فقرة من الفقرات الـ (2) الآتية:
1- المادة التي تعتبر حمضاً حسب تعريف لويس فقط هي:
أ) HNO3
ب) H2O
ج) HCOOH
د) Mn2+
2- أحد محاليل الأملاح الآتية (متساوية التركيز) له أعلى قيمة pH :
أ) NaCl
ب) KCl
ج) KNO3
د) CH3COONa
ب-  لديك أربعة محاليل مائية لبعض الحموض الضعيفة متساوية التركيز (0.1 M) لكل منها. معتمداً على المعلومات الواردة في الجدول المجاور أجب عن الأسئلة الآتية:
لديك أربعة محاليل مائية لبعض الحموض الضعيفة متساوية التركيز (0.1 M) لكل منها. معتمداً على المعلومات الواردة في الجدول المجاور أجب عن الأسئلة الآتية:
1- احسب قيمة Ka للحمض HZ .
Ka = =
Ka = = 16 x 10-9
2- أي الحموض قاعدته المرافقة هي الأقوى؟
HA
3- في التفاعل الآتي:
HX + Z- HZ + X-
-حدد الزوجين المترافقين من الحمض والقاعدة.
(HX/X-) , (Z-/HZ)
-أي الاتجاهين يرجح الاتزان؟
يرجح الاتزان جهة النواتج (الاتجاه الأمامي).
ج- محلول مكون من القاعدة الضعيفة (N2H4) تركيزه (0.1 M) والملح (N2H5Cl) تركيزه (0.2 M)، فإذا علمت أن قيمة Kb للقاعدة = 1 x 10-6 ، وقيمة Kw = 1 x 10-14.
أجب عن الأسئلة التالية:
1- اكتب صيغة الأيون المشترك.
N2H5+
2- احسب قيمة pH للمحلول (log 2 = 0.3).
Kb =
1 x 10-6 =
[OH-] = 0.5 x 10-6 = 5 x 10-7 M
[H3O+] = = = 2 x 10-8 M
pH = - log [H3O+] = - log (2 x 10-8) = 8 - log 2 = 8 - 0.3 = 7.7
إعداد : شبكة منهاجي التعليمية
07 / 02 / 2023
النقاشات