أسئلة وزارية (الحموض والقواعد)
الدورات (2006-2010)
الدورة الشتوية 2006
أ- انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لكل فقرة من الفقرات الآتية:
1- إحدى الصيغ الآتية تسلك كحمض وقاعدة حسب مفهوم برونستد ولوري:
أ) HCO3-
ب) NH4+
ج) H3O+
د) CO32-
2- الأيون المشترك في المحلول المكون من حمض HCOOH والملح HCOONa هو:
أ) COONa-
ب) HCOO-
ج) HCO+
د) COOH3+
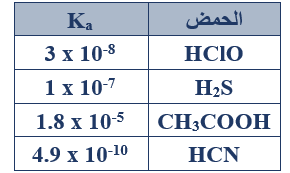 ب- لديك أربعة محاليل مائية لبعض الحموض الضعيفة متساوية التركيز (0.1 M) لكل منها. معتمداً على المعلومات الواردة في الجدول المجاور أجب عن الأسئلة الآتية:
ب- لديك أربعة محاليل مائية لبعض الحموض الضعيفة متساوية التركيز (0.1 M) لكل منها. معتمداً على المعلومات الواردة في الجدول المجاور أجب عن الأسئلة الآتية:
1- أي المحاليل له أعلى قيمة pH ؟
HCN
2- أي القاعدتين HS- ، CH3COO- هي الأقوى؟
HS-
3- أكمل المعادلة الآتية ثم حدد الأزواج المترافقة من الحمض والقاعدة:
CH3COOH + ClO- …… + ……
CH3COOH + ClO- CH3COO- + HClO
الأزواج المترافقة: (CH3COOH/CH3COO-) , (ClO-/HClO)
4- احسب تركيز أيون الهيدرونيوم في محلول الحمض H2S .
H2S + H2O H3O+ + HS-
Ka = =
1 x 10-7 =
[H3O+] = = 1 x 10-4 M
pH = -log [H3O+] = -log (1 x 10-4) = 4
ج- محلول مكون من القاعدة الضعيفة (CH3NH2) تركيزها (0.2 M) والملح (CH3NH3Br) تركيزه (0.3 M)، فإذا علمت أن قيمة Kb للقاعدة = 4 x 10-4. احسب pH للمحلول الناتج. (علماً بأن log 3.7 = 0.57) ، (Kw = 1 x 10-14)
Kb =
4 x 10-4 =
[OH-] = 2.66 x 10-4 M
[H3O+] = = = 0.37 x 10-10 = 3.7 x 10-11 M
pH = - log [H3O+] = - log (3.7 x 10-11) = 11 - log 3.7 = 11 - 0.57 = 10.43
الدورة الصيفية 2006
أ- انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لكل فقرة من الفقرات الآتية:
1- الأيون الذي يعتبر قاعدة حسب تعريف لويس هو:
أ) I-
ب) Cd2+
ج) Ag+
د) NH4+
2- أي من محاليل الأملاح الآتية يعتبر حمضي التأثير:
أ) NH4Cl
ب) NaCl
ج) CH3COONa
د) KCl
 ب- في الجدول المجاور خمسة محاليل تركيز كل منها (0.1 M). اعتماداً على المعلومات الواردة عن كل منها في الجدول، أجب عما يأتي:
ب- في الجدول المجاور خمسة محاليل تركيز كل منها (0.1 M). اعتماداً على المعلومات الواردة عن كل منها في الجدول، أجب عما يأتي:
1- حدد أقوى حمض.
HA
2- احسب قيمة Kb للقاعدة D. علماً أن Kw = 1 x 10-14
[OH-] = = = 4 x 10-5 M
D + H2O OH- + HD+
Kb = =
Kb = = 16 x 10-9
3- في المعادلة الآتية حدّد الاتجاهين يرجح الاتزان:
HA + C- HC + A-
يرجح الاتزان جهة النواتج (الاتجاه الأمامي).
4- ما أثر إضافة ملح NaB إلى محلول حمض HB على تركيز [H3O+] (يقل، يزداد، يبقى ثابت)؟
يقل.
ج- أكمل التفاعل الآتي ثم حدّد الأزواج المترافقة من الحمض والقاعدة:
CH3CH2O- + CH3NH3+ ……….….. + ……….…..
CH3CH2O- + CH3NH3+ CH3CH2OH + CH3NH2
د- احسب كتلة (KOH) المذابة في (500 mL) من المحلول إذا كانت قيمة pH للمحلول تساوي (13).
(الكتلة المولية لـ H = 1 ، O = 16 ، K = 39 ، Kw = 1 x 10-14).
[H3O+] = 10-pH = 10-13 = 1 x 10-13 M
[OH-] = = = 1 x 10-1 M = 0.1 M
[OH-] = [KOH] = 0.1 M
n = M x V = 0.1 x 0.5 = 0.05 mol
m = n x Mr = 0.05 x 56 = 2.8 g
الدورة الشتوية 2007
أ- انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لكل فقرة من الفقرات الآتية على الترتيب:
1- يتطلب تعريف الحموض والقواعد حسب مفهوم أرهينيوس شرطاً أساسياً هو:
أ) إيصالها للتيار الكهربائي.
ب) ذوبانها في وسط غير مائي.
ج) ذوبانها في وسط مائي.
د) استخدام كواشف خاصة.
2- الملح الذي إذا أذيب في الماء فإن قيمة pH لمحلوله تكون أقل من (7) هو:
أ) NaNO3
ب) KCN
ج) Na2CO3
د) NH4Cl
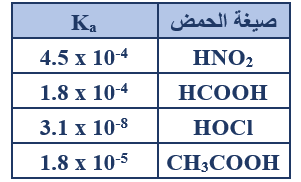 ب- اعتماداً على الجدول المجاور والذي يبين قيم ثابت التأين (Ka) لعدد من الحموض الضعيفة المتساوية التركيز أجب عما يأتي:
ب- اعتماداً على الجدول المجاور والذي يبين قيم ثابت التأين (Ka) لعدد من الحموض الضعيفة المتساوية التركيز أجب عما يأتي:
1- اكتب صيغة القاعدة المرافقة للحمض الأضعف.
OCl-
2- اكتب معادلة تفاعل الحمض HCOOH مع الماء.
HCOOH + H2O HCOO- + H3O+
3- حدد الثنائيات المترافقة من الحمض والقاعدة في المعادلة السابقة.
الثنائيات المترافقة: (HCOOH/HCOO-) , (H2O/H3O+)
4- أي الحموض له أقل قيمة pH؟
HNO2
5- احسب [H3O+] لمحلول تركيزه (0.01 M) من الحمض CH3COOH.
CH3COOH + H2O CH3COO- + H3O+
Ka = =
1.8 x 10-5 =
[H3O+] = = 4.2 x 10-4 M
ج- محلول مكون من القاعدة NH2OH تركيزها (0.2 M) ومحلول الملح NH2OH2Cl تركيزه (0.3 M) مع العلم أن قيمة Kb للقاعدة تساوي (1.1 x 10-8)، أجب عما يأتي:
1- احسب تركيز [OH-] .
1.1 x 10-8 =
[OH-] = 7.3 x 10-9 M
2- ما صيغة الأيون المشترك؟
NH2OH2+
الدورة الصيفية 2007
أ) انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لكل فقرة من الفقرات الآتية على الترتيب:
1- أحد المحاليل الآتية ليس (حمض / قاعدة) مترافقان:
أ) H2SO4 / HSO4-
ب) H2CO3 / HCO3-
ج) H3PO4 / HPO42-
د) NH3 / NH2-
2- المحلول الذي له أعلى قيمة pH من بين المحاليل الآتية المتساوية في التركيز:
أ) HNO3
ب) H2SO3
ج) HCOOH
د) NaCl
ب) إذا كان لديك الجدول الآتي الذي يحتوي على معلومات متعلقة بالحمضين الضعيفين (1، 2).
ادرسه جيداً وأجب عن الأسئلة التي تليه: (Kw = 1 x 10-14)
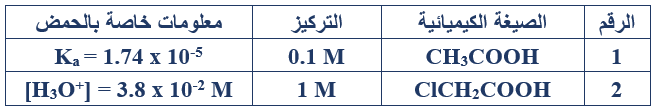
1- ما المقصود بمصطلح الحمض الضعيف؟
هو الحمض الذي يتفكك جزئياً في الماء.
2- اكتب معادلة تفكك الحمض رقم (2) في الماء.
ClCH2COOH + H2O ClCH2COO- + H3O+
3- احسب [OH-] في الحمض رقم (1).
CH3COOH + H2O CH3COO- + H3O+
Ka = =
1.74 x 10-5 =
[H3O+] = = 1.3 x 10-3 M
[OH-] = = = 0.77 x 10-11 = 7.7 x 10-12 M
4- احسب قيمة Ka للحمض رقم (2).
ClCH2COOH + H2O ClCH2COO- + H3O+
Ka = =
Ka = = 14.44 x 10-4
5- أيهما أقوى كقاعدة ClCH2COO- أم CH3COO- ؟ فسّر إجابتك.
؛ CH3COO- لأنها ناتجة من حمض أضعف.
ج) إذا أضيفت كمية من ملح NH4Cl إلى (500 mL) من محلول (0.1 M) من NH3 حتى أصبح [H3O+] يساوي 1 x 10-9 M، احسب عدد مولات NH4Cl التي أضيفت إلى المحلول. (Kb = 1.8 x 10-5)
[OH-] = = = 1 x 10-5 M
Kb =
1.8 x 10-5 =
[NH4+] = [NH4Cl] = 0.18 M
n = M x V = 0.18 x 0.5 = 0.09 mol
الدورة الشتوية 2008
أ) انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لها:
1) أحد الآتية يعتبر من حموض لويس:
أ) Ni2+
ب) NF3
ج) PH3
د) CH3NH2
2) أحد الأملاح الآتية حمضي التأثير:
أ) HCOONa
ب) KBr
ج) CH3NH3Cl
د) NaNO3
ب) لديك المحلولين اللذين يحملان الرقمين (1 ، 2)، المحلول (1) هو محلول KOH تركيزه (1 x 10-4 M)، المحلول (2) هو محلول H2S تركيزه (1 x 10-1 M). قيمة Ka له تساوي (1 x 10-7) احسب قيمة:
1) pH للمحلول رقم (1).
H2S + H2O HS- + H3O+
Ka = =
1 x 10-7 =
[H3O+] = = 1 x 10-4 M
pH = - log [H3O+] = - log (1 x 10-4) = 4
2) pH للمحلول رقم (2).
KOH K+ + OH-
[OH-] = [KOH] = 1 x 10-4 M
[OH-] = = = 1 x 10-10 M
pH = - log [H3O+] = - log (1 x 10-10) = 10
ج) 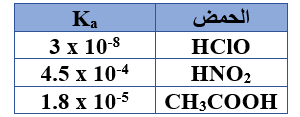 اعتماداً على الجدول المجاور، أجب عن الأسئلة الآتية:
اعتماداً على الجدول المجاور، أجب عن الأسئلة الآتية:
1- اكتب صيغة الحمض الأقوى.
HNO2
2- اكتب صيغة القاعدة المرافقة الأقوى.
ClO-
3- إذا تساوت محاليل الحموض في التركيز فأيها له أقل قيمة pH ؟
HNO2
د) محلول مكون من (CH3NH2 تركيزه 0.5 M و CH3NH3Cl تركيزه 0.4 M) Kb لـ CH3NH2 = 4 x 10-4.
1- اكتب صيغة الأيون المشترك.
CH3NH3+
2- احسب pH للمحلول.
Kb =
4 x 10-4 =
[OH-] = 5 x 10-4 M
[H3O+] = = = 2 x 10-11 M
pH = - log [H3O+] = - log (2 x 10-11) = 11 - log 2 = 11 - 0.3 = 10.7
3- إذا أضيف (0.2 M) من HBr احسب pH بعد الإضافة. (log 5 = 0.7 , log 2 = 0.3)
Kb =
4 x 10-4 =
[OH-] = 2 x 10-4 M
[H3O+] = = = 5 x 10-11 M
pH = - log [H3O+] = - log (5 x 10-11) = 11 - log 5 = 11 - 0.7 = 10.3
الدورة الصيفية 2008
أ) انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لها:
1) أي من الآتية يمكن أن يسلك كحمض وكقاعدة:
أ) CH3NH3+
ب) HCOO-
ج) HCO3-
د) SO32-
2) إن إضافة الملح RCOONa للحمض RCOOH يؤدي إلى:
أ) زيادة pH.
ب) تقليل pH.
ج) تقليل Ka.
د) زيادة [H3O+].
ب) إذا كان تركيز H3O+ في محلول الحمض HX يساوي 8 x 10-2 M و pH لمحلول الحمض HY تساوي (2.5). أجب عما يأتي:
1- حدّد الأزواج المترافقة في التفاعل: HX + Y- HY + X-
(HX/X-) , (Y-/HY)
2- حدد الجهة التي يرجحها الاتزان.
يرجح الاتزان جهة النواتج.
ج) الجدول الآتي يبين عدد من المحاليل الافتراضية وقيم pH لها:
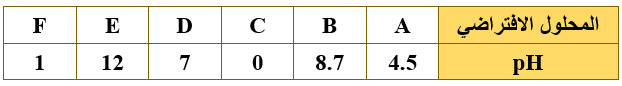
فأي المحاليل يمثل:
1- القاعدة الأقوى.
E
2- محلول NaCl .
D
3- محلول HNO3 تركيزه 0.1 M
F
4- قاعدة فيها [OH-]يساوي 5 x 10-6 M
B
5- حمضاً فيه [H3O+] يساوي 3 x 10-5 M
A
د) حدّد حمض وقاعدة لويس في محلول [Co(NH3)4]2+ .
حمض لويس: Co2+ ، قاعدة لويس: NH3
هـ) محلول مكوّن من RNH2 تركيزها (0.04 M) والملح RNH3Cl تركيزه (0.04 M).
1- اكتب معادلة تفكك كل منهما في الماء.
RNH2 + H2O RNH3+ + OH-
RNH3Cl RNH3+ + Cl-
2- حدّد صيغة الأيون المشترك.
RNH3+
3- إذا كانت pH للمحلول تساوي (8.3) احسب Kb لـ RNH2 .
[H3O+] = 10-pH = 10-8.3 = 5 x 10-9 M
[OH-] = = = 2 x 10-6 M
Kb = =
Kb = 2 x 10-6
4- اكتب معادلة تحضير RNH3Cl من RNH2 .
RNH2 + HCl → RNH3Cl
و) ما طبيعة تأثير الملح RCOOK (حمضي، قاعدي، متعادل)؟
قاعدي.
(log 5 = 0.7 , log 3 = 0.5 , log 2 = 0.3)
إعداد : شبكة منهاجي التعليمية
11 / 01 / 2023
النقاشات