أسئلة وزارية (الحموض والقواعد)
الدورات (2022-2020)
خطة 2020 الطلبة النظاميون
اختر الإجابة الصحيحة في كل فقرة مما يأتي، ثم ظلل بشكل غامق الدائرة التي تشير إلى رمز الإجابة في نموذج الإجابة (ورقة القارىء الضوئي) فهو النموذج المعتمد (فقط) لاحتساب علامتك، علماً بأن عدد الفقرات (15):
1- تُعد الأمونيا NH3 قاعدة عند تفاعلها مع الماء وفق مفهوم برونستد - لوري لأنها:
أ- تستقبل بروتون.
ب- تمنح بروتون.
ج- تستقبل OH-
د- تمنح OH-
2- الأيون الذي يمثل القاعدة المرافقة الأقوى فيما يلي:
أ- Cl-
ب- NO3-
ج- CN-
د- ClO4-
3- أحد الآتية زوج مترافق ينتج من تفاعل N2H4 مع NH4+ هو:
أ- N2H4/NH4+
ب- N2H5+/NH3
ج- N2H4/ N2H5+
د- N2H5+/NH4+
4- المادة التي تسلك سلوكاً أمفوتيرياً من المواد الآتية، هي:
أ- HCO3-
ب- HCOO-
ج- Cl-
د- NH4+
5- المحلول الذي لا يسلك سلوكاً حمضياً وفق مفهوم أرهينيوس، هو:
أ- HCN
ب- HClO
ج- NH4Cl
د- HI
6- محلول الحمض HBr تم تحضيره بإذابة (0.05 mol) من الحمض في (50 mL) من المحلول فإن قيمة pH له تساوي:
أ- 0
ب- 1
ج- 3
د- 5
7- محلول قاعدة ضعيفة تركيزه (0.1 M) وقيمة pH له (9) فإن قيمة Kb للقاعدة تساوي:
(= 1 x 10-14 Kw)
أ- 1 x 10-10
ب- 1 x 10-9
ج- 1 x 10-8
د- 1 x 10-4
8- الأيون الذي يتفاعل مع الماء وينتج أيون الهيدرونيوم (H3O+) هو:
أ- Na+
ب- OCl-
ج- NO3-
د- NH4+
9- عند إضافة بلورات ملح NaF إلى محلول الحمض HF فإن:
أ- pH تزداد.
ب- pH تقل.
ج- Ka تزداد.
د- Ka تقل.
10- صيغة الأيون المشترك لمحلول يتكون من CH3NH3Cl والقاعدة CH3NH2 هي:
أ- CH3NH2+
ب- CH3NH3+
ج- CH3NH2-
د- CH3NH-
11- محلول من حمض HNO2 تركيزه (0.1 M) أضيفت إليه بلورات من ملح NaNO2 فأصبحت قيمة pH = 4 فإن تركيز الملح بوحدة (M) يساوي:
(أهمل تغيّر الحجم، Ka للحمض HNO2 = 4 x 10-4)
أ- 4 x 10-9
ب- 4 x 10-8
ج- 4 x 10-1
د- 4
12- محلولان لحمضين افتراضيين (HX) Ka = 2 x 10-4 و (HY) Ka = 1 x 10-4 فإن العبارة الصحيحة فيما يتعلق بخصائص أملاحهما NaX و NaY لهما التركيز نفسه، هي:
أ- محلول ملح NaX تركيز OH- فيه الأعلى.
ب- محلول ملح NaY تركيز OH- فيه الأعلى.
ج- محلول ملح NaX قيمة pH فيه الأعلى.
د- محلول ملح NaY قيمة pH فيه الأقل.
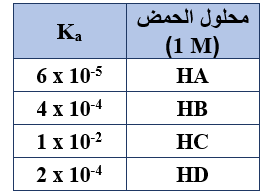 ادرس المعلومات الواردة في الجدول لمحاليل حموض افتراضية ضعيفة، وأجب عن الفقرات (13 و 14 و 15)
ادرس المعلومات الواردة في الجدول لمحاليل حموض افتراضية ضعيفة، وأجب عن الفقرات (13 و 14 و 15)
13- المحلول الذي يكون فيه قيمة pH الأعلى هو:
أ- HA
ب- HB
ج- HC
د- HD
14- المحلول الذي يكون فيه تركيز H3O+ يساوي (0.02 M) هو:
أ- HA
ب- HB
ج- HC
د- HD
15- محلول الحمض الذي تكون قاعدته المرافقة الأضعف، هو:
أ- HA
ب- HB
ج- HC
د- HD
الدورة التكميلية 2020 الطلبة النظاميون
اختر الإجابة الصحيحة في كل فقرة مما يأتي، ثم ظلل بشكل غامق الدائرة التي تشير إلى رمز الإجابة في نموذج الإجابة (ورقة القارىء الضوئي) فهو النموذج المعتمد (فقط) لاحتساب علامتك، علماً بأن عدد الفقرات (17):
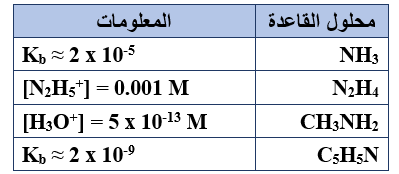 يبين الجدول المجاور أربعة محاليل لقواعد ضعيفة متساوية التركيز (1 M) ومعلومات عنها، ادرسه ثم أجب عن الفقرات (6 , 5 , 4 , 3 , 2 , 1)، علماً بأن (Kw = 1 x 10-14).
يبين الجدول المجاور أربعة محاليل لقواعد ضعيفة متساوية التركيز (1 M) ومعلومات عنها، ادرسه ثم أجب عن الفقرات (6 , 5 , 4 , 3 , 2 , 1)، علماً بأن (Kw = 1 x 10-14).
1- محلول القاعدة الذي يكون فيه أقل تركيز لأيونات H3O+ ، هو:
أ- NH3
ب- N2H4
ج- CH3NH2
د- C5H5N
2- قيمة pH في محلول N2H4 تساوي:
أ- 14
ب- 11
ج- 9
د- 3
3- الأيون الذي يمثل الحمض الأقوى، هو:
أ- NH4+
ب- N2H5+
ج- CH3NH3+
د- C5H5NH+
4- الزوج المترافق من الحمض والقاعدة NH3/NH4+ وفق مفهوم برونستد-لوري ينتج من تفاعل:
أ- NH3 مع H2O
ب- NH4+ مع H3O+
ج- NH4+ مع N2H5+
د- NH3 مع OH-
5- ينتج الأيون المشترك CH3NH3+ من المحلول المكون من:
أ- CH3NH2/HCl
ب- CH3NH3Cl/HCl
ج- CH3NH2/H2O
د- CH3NH3Cl/ CH3NH2
6- أضيفت بلورات من ملح كلوريد الهيدرازين N2H5Cl إلى محلول الهيدرازين N2H4 ، فإن العبارة الصحيحة في ما يتعلق بالمحلول الناتج، هي:
أ- تزداد قيمة pH
ب- يزداد تأين N2H4
ج- يزداد [OH-]
د- تقل قيمة pH
7- محلول حمض ضعيف HZ تركيزه (0.2 M) ورقمه الهيدروجيني يساوي (4) فإن قيمة Ka له تساوي:
أ- 5 x 10-8
ب- 5 x 10-7
ج- 5 x 10-4
د- 5 x 10-3
8- يُعد H+ في HCl حمضاً وفق مفهوم لويس لأنه:
أ- يستقبل بروتوناً.
ب- يمنح بروتوناً.
ج- يستقبل زوجاً من الإلكترونات.
د- يحتوي فلكاً مكتملاً بالإلكترونات.
9- المادة التي تسلك كحمض في بعض تفاعلاتها وكقاعدة في تفاعلات أخرى:
أ- SO32-
ب- HSO3-
ج- HCOO-
د- OH-
10- محلول القاعدة KOH قيمة pH له (12)، فإن تركيز المحلول (M) يساوي (Kw = 1 x 10-14):
أ- 1 x 10-2
ب- 1 x 10-12
ج- 2 x 10-2
د- 2 x 10-12
11- محلول حمض افتراضي HA تركيزه (0.02 M) أضيف إلى لتر منه (0.04 mol) من بلورات الملح NaA فإن قيمة pH للمحلول تساوي (أهمل تغير الحجم، Ka للحمض = 2 x 10-4):
أ- 2
ب- 4
ج- 6
د- 8
12- الأيون الذي يتفاعل مع الماء وينتج أيون الهيدرونيوم (H3O+)، هو:
أ- Na+
ب- Cl-
ج- F-
د- NH4+
13- محلول الملح الذي له أقل قيمة pH من بين المحاليل الآتية المتساوية في التركيز هو الناتج من تعادل:
أ- NH3/HCl
ب- HCN/NaOH
ج- HF/KOH
د- HNO3/KOH
14- محلولان لحمضين افتراضيين (HX و HY) لهما التركيز نفسه، تركيز أيونات H3O+ في محلول الحمض HX يساوي (0.01 M) وقيمة pH لمحلول الحمض HY تساوي (3)، فإن العبارة الصحيحة هي:
أ- قيمة Ka للحمض HX أقل من قيمة Ka للحمض HY
ب- القاعدة المرافقة X- أقوى من القاعدة المرافقة Y-
ج- تركيز أيونات OH- في محلول HX أعلى منها في محلول HY
د- تركيز أيونات X- في محلول HX أعلى من تركيز أيونات Y- في محلول HY
15- الترتيب الصحيح للمحاليل المائية الآتية (KOH , NH4Cl , KCN , KCl) المتساوية في التركيز وفق pH :
أ- KOH > KCN > KCl > NH4Cl
ب- KOH > KCN > NH4Cl > KCl
ج- NH4Cl > KCl > KCN > KOH
د- KCN > NH4Cl > KCl > KOH
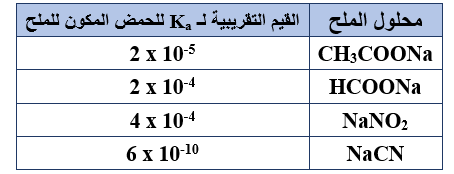 يبين الجدول المجاور عدداً من محاليل أملاح الصوديوم متساوية التركيز، وقيم Ka للحموض المكونة لها (عند التركيز نفسه)، أجب عن الفقرتين 16 ، 17:
يبين الجدول المجاور عدداً من محاليل أملاح الصوديوم متساوية التركيز، وقيم Ka للحموض المكونة لها (عند التركيز نفسه)، أجب عن الفقرتين 16 ، 17:
16- الملح الأكثر تميّهاً هو:
أ- CH3COONa
ب- HCOONa
ج- NaNO2
د- NaCN
17- ينتج الملح NaNO2 عن تفاعل NaOH مع:
أ- HNO2
ب- HCl
ج- HNO3
د- HCN
دورة 2021
اختر الإجابة الصحيحة في كل فقرة مما يأتي، ثم ظلل بشكل غامق الدائرة التي تشير إلى رمز الإجابة في نموذج الإجابة (ورقة القارىء الضوئي) فهو النموذج المعتمد (فقط) لاحتساب علامتك، علماً بأن عدد الفقرات (15):
1- المعادلة التي تفسر السلوك الحمضي وفقاً لمفهوم أرهينيوس، هي:
أ- HClO4(l) H+(aq) + ClO4-(aq)
ب- HClO4(l) + H2O(l) → H3O+(aq) + ClO4-(aq)
ج- HF(aq) + CN-(aq)  F-(aq) + HCN(aq)
F-(aq) + HCN(aq)
د- Zn2+(aq) + 4H2O(l) → [Zn(H2O)4]2+(aq)
2- تترتب القواعد المرافقة لمحاليل الحموض الضعيفة الافتراضية (HA , HX , HY , HZ) المتساوية في التركيز تبعاً لقوتها كالآتي (A- < Z- < X- < Y-)، فإن الحمض الذي له أعلى قيمة Ka هو:
أ- HZ
ب- HY
ج- HX
د- HA
3- المادة التي تسلك سلوكاً أمفوتيرياً:
أ- H2CO3
ب- HCOO-
ج- H2SO3
د- HS-
4- الأيون المشترك في المحلول المتكون من القاعدة C5H5N والملح C5H5NHCl ، هو:
أ- C5H5NH+
ب- C5H4NH+
ج- C5H5NH2+
د- C5H4NH3+
5- محلول حمض HNO3 فيه تركيز أيونات NO3- (2 x 10-2 M)، فإن تركيز المحلول (M) يساوي:
أ- 2 x 10-2
ب- 2 x 10-10
ج- 5 x 10-2
د- 5 x 10-10
6- نواتج تفاعل NH4+ مع CH3NH2 ، هي:
أ- CH3NH3+ و NH3
ب- NH3 و CH3NH-
ج- NH4+ و CH3NH+
د- NH4+ و CH3NH3-
7- يسلك الماء H2O في تفاعله مع ClO- سلوكاً مماثلاً لسلوك إحدى المواد الآتية، هي:
أ- C5H5N
ب- NH4+
ج- OH-
د- NH3
8- محلول حمض الميثانويك HCOOH حجمه (500 mL)، وتركيزه (0.5 M)، أضيفت إليه بلورات من ملح ميثانوات الصوديوم HCOONa ، كتلته المولية (68 g/mol)، فتغيرت قيمة pH بمقدار (2)، فإذا علمت أن Ka للحمض (2 x 10-4)، فإن كتلة بلورات الملح المضافة (g) تساوي: (أهمل التغير في الحجم)
أ- 34
ب- 3.4
ج- 0.34
د- 0.034
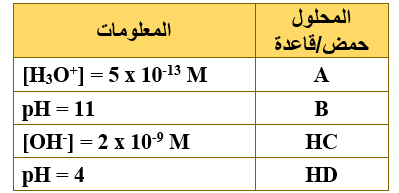 يبين الجدول المجاور أربعة رموز افتراضية لمحاليل حموض وقواعد ضعيفة متساوية التركيز (1 M) ومعلومات عنها، ادرسه ثم أجب عن الفقرات (12،11،10،9)، علماً بأن (Kw = 1 x 10-14، log 5 = 0.7).
يبين الجدول المجاور أربعة رموز افتراضية لمحاليل حموض وقواعد ضعيفة متساوية التركيز (1 M) ومعلومات عنها، ادرسه ثم أجب عن الفقرات (12،11،10،9)، علماً بأن (Kw = 1 x 10-14، log 5 = 0.7).
9- رمز المحلول الذي يكون فيه تركيز OH- الأعلى:
أ- A
ب- B
ج- HC
د- HD
10- إضافة بلورات من ملح NaD إلى محلول HD يؤدي إلى:
أ- زيادة [H3O+]
ب- نقصان [OH-]
ج- نقصان قيمة pH
د- زيادة [HD]
11- محلول B تركيزه (0.04 M)، فإن قيمة pH له تساوي:
أ- 8.3
ب- 9.3
ج- 10.3
د- 11.3
12- العبارة الصحيحة المتعلقة بمحلولي الملحين NaC و NaD لهما التركيز نفسه، هي:
أ- قيمة pH لمحلول NaD أكبر من قيمة pH لمحلول NaC
ب- محلول NaD أقل قدرة على التميه من محلول NaC
ج- طبيعة محلول NaD حمضية، وطبيعة محلول NaC قاعدية.
د- قيمة Ka لمحلول HD أقل من قيمة Ka لمحلول HC
13- إذا علمت أن قيمة Kb لمحلول ميثيل أمين CH3NH2 أكبر من قيمة Kb لمحلول الهيدرازين N2H4 ، لهما التركيز نفسه، فإن العبارة الصحيحة:
أ- قيمة pH لمحلول CH3NH2 أقل من قيمة pH لمحلول N2H4
ب- [N2H5+] أكبر من [CH3NH3+]
ج- الحمض المرافق لمحلول N2H4 أقوى من الحمض المرافق لمحلول CH3NH2
د- [OH-] متساوٍ في المحلولين.
14- المحلول الذي له أقل pH في المحاليل الآتية المتساوية التركيز، هو:
أ- NH4Cl
ب- NaCN
ج- H2SO3
د- KClO4
15- الحمض والقاعدة المكونان للملح NaOCl ، هما:
أ- NaO و HCl
ب- NaOH و HCl
ج- Na و HOCl
د- NaOH و HOCl
الدورة التكميلية 2021
1- في التفاعل:NH3(aq) + H+(aq)  NH4+(aq) يسلك H+ ، وفقًا لمفهوم لويس سلوكًا:
NH4+(aq) يسلك H+ ، وفقًا لمفهوم لويس سلوكًا:
أ- حمضياً لأنه يمنح زوجاً من الإلكترونات.
ب- قاعدياً لأنه يمنح زوجاً من الإلكترونات.
ج- قاعدياً لأنه يستقبل زوجاً من الإلكترونات.
د- حمضياً لأنه يستقبل زوجاً من الإلكترونات.
2- الحمض المرافق للقاعدة OH- هو:
أ- H3O+
ب- H2O
ج- O2-
د- H+
3- يتفاعل الحمض HOCI مع القاعدة المرافقة للحمض H2CO3، فإن أحد نواتج التفاعل هو:
أ- HOCl
ب- CO32-
ج- HCO3-
د- H2CO3
4- في محاليل قواعد متساوية التركيز، يكون تركيز [H3O+] لمحلول القاعدة الأقل تأيناً في الماء يساوي:
أ- 2 x 10-8
ب- 1 x 10-8
ج- 1 x 10-11
د- 2 x 10-11
5- المادة التي تمنح بروتوناً في بعض تفاعلاتها، وتستقبل بروتوناً في تفاعلات أخرى، هي:
أ- HCOO-
ب- H3O+
ج- H2PO4-
د- NH4+
6- محلول المادة (X) يتأين كليًا في الماء؛ فإذا علمت أن قيمة الرقم الهيدروجيني pH له تساوي (9)، فإن تركيزه (M) يساوي: (Kw = 1 x 10-14)
أ- 1 x 10-10
ب- 1 x 10-9
ج- 1 x 10-5
د- 1 x 10-4
7- حمض ضعيف يُرمز له بالرمز HA تركيزه (0.1 M) فإن العبارة الصحيحة:
أ- [A-] أكبر من 0.1
ب- [H3O+] أقل من 0.1
ج- pH أقل من 1
د- [H3O+] أكبر من 0.1
8- في التفاعل:HS-(aq) + H2O(l)  S2-(aq) + H3O+(aq) ، يسلك الماء سلوكًا:
S2-(aq) + H3O+(aq) ، يسلك الماء سلوكًا:
أ- قاعدياً.
ب- حمضياً.
ج- أمفوتيرياً.
د- متعادلاً.
9- محلول الحمض الذي له أعلى قيمة pH من بين المحاليل الآتية متساوية التركيز، هو:
أ- HNO3
ب- HClO3
ج- HI
د- HBr
- يبين ال
 جدول المجاور ثلاثة محاليل لقواعد افتراضية ضعيفة مختلفة التراكيز، ادرسه ثم أجب عن الفقرات (10،11،12)، علماً بأن:
جدول المجاور ثلاثة محاليل لقواعد افتراضية ضعيفة مختلفة التراكيز، ادرسه ثم أجب عن الفقرات (10،11،12)، علماً بأن:
(Kw = 1 x 10-14، log 5 = 0.7).
10- الترتيب الصحيح لمحاليل القواعد الضعيفة وفقاً لقيمة Kb، هو:
أ- Z<Y<X
ب- Z<X<Y
ج- X<Y<Z
د- X<Z<Y
11- قيمة pH لمحلول القاعدة Y، تساوي:
أ- 11.3
ب- 11.5
ج- 3.7
د- 3.5
12- العبارة الصحيحة المتعلقة بمحلولي الملحين XHCI و YHCI لهما التركيز نفسه (1 M)، هي:
أ- طبيعة محلول XHCI حمضية، وطبيعة محلول YHCI قاعدية.
ب- تركيز أيونات OH- في محلول XHCI أعلى منها في محلول YHCI
ج- محلول XHCI أعلى قدرة على التميه من محلول YHCI
د- صيغة الأيون المشترك في محلول يتكوّن من القاعدة X والملح XHCI هي X-
13- محلول الحمض HNO2 فيه تركيز [H3O+] يساوي (2 x 10-3 M)، أضيفت إليه بلورات ملح NaNO2 تركيزه (0.4 M)، فإن قيمة pH للمحلول: ( Ka الحمض 4 x 10-4 ، log 2 = 0.3) (أهمل التغير في الحجم)
أ- تزداد بمقدار 2.3
ب- تقل بمقدار 2.3
ج- تزداد بمقدار 5
د- تقل بمقدار 5
14- ينتج المركب C من تفاعل الحمض A مع القاعدة B، وجد أن قيمة pH لمحلول C أقل من (7)، فإن العبارة التي تصف C, B, A ، هي:
أ- A حمض ضعيف، B قاعدة قوية، وC ملح حمضي التأثير.
ب- A حمض ضعيف، B قاعدة قوية، وC ملح قاعدي التأثير.
ج- A حمض قوي، B قاعدة ضعيفة، وC ملح متعادل التأثير.
د- A حمض قوي B قاعدة ضعيفة، وC ملح حمضي التأثير.
15- محلول مكون من الحمض H2SO3 والملح KHSO3، فيه نسبة تركيز الحمض إلى الملح تساوي (0.1)، فإن تركيز [H3O+] (M) يساوي: (Ka acid = 1.5 x 10-2)
أ- `1.5 x 10-1
ب- 1.5 x 10-2
ج- 1.5 x 10-3
د- 1.5 x 10-4
الدورة التكميلية 2022
اختر الإجابة الصحيحة في كل فقرة مما يأتي، ثم ظلل بشكل غامق الدائرة التي تشير إلى رمز الإجابة في نموذج الإجابة (ورقة القارىء الضوئي) فهو النموذج المعتمد (فقط) لاحتساب علامتك، علماً بأن عدد الفقرات (15):
1- المادة التي تسلك سلوكاً حمضياً عند تفاعلها مع NH3 :
أ- OH-
ب- CN-
ج- H2PO4-
د- HCOO-
2- محلول KNO3 تركيزه (0.1 M)، وتغير تركيزه ليصبح (0.01 M)، فإن: (أهمل التغير في الحجم)
أ- pH تزداد
ب- [OH-] تقل
ج- pH تثبت
د- [H3O+] تزداد
3- الزوج المترافق من الحمض والقاعدة H2O/H3O+ ناتج من تفاعل:
أ- H2O + CN-
ب- H2O + HCOO-
ج- H2O + H2CO3
د- H2O + C5H5N
4- المحلول الملحي من محاليل الأملاح الآتية المتساوية التركيز التي يكون فيها تركيز [OH-] الأعلى هو:
أ- CH3COONa
ب- NaCl
ج- NH4Cl
د- NaBr
5- محلول قاعدة ضعيفة تركيزه (0.4 M)، فإن تركيز [H3O+] (M) يساوي:
( Kw = 1 x 10-14 ، Kb القاعدة = 1 x 10-9 )
أ- 2 x 10-5
ب- 2 x 10-10
ج- 5 x 10-12
د- 5 x 10-10
6- المادة التي لا تسلك سلوكاً أمفوتيرياً في تفاعلاتها:
أ- HCOO-
ب- HSO3-
ج- H2O
د- HCO3-
7- المادة التي لا تسلك سلوكاً حمضياً وفق مفهوم كل من أرهينيوس وبرونستد – لوري:
أ- HI
ب- NH4Cl
ج- N2H5I
د- Cu2+
8- محلول مكون من القاعدة الضعيفة B والملح BHCl المتساويين في التركيز له pH يساوي (9)، وعند تغير تراكيز كل من الملح والقاعدة لتصبح pH المحلول تساوي (8)، فإن نسبة ]القاعدة[ إلى ]الملح[ تساوي: (أهمل التغير في الحجم) علماً أن (Kw = 1 x 10-14)
أ- 10
ب- 0.1
ج- 0.01
د- 0.001
- ادرس المعلومات الآتية لمحاليل القواعد الافتراضية (D,C,B,A) المتساوية التركيز، ثم أجب عن الفقرات (11, 10, 9) علماً أن (Kw = 1 x 10-14)
- قيمة pH القاعدة B أقل منها للقاعدة C
- الملح DHCl أكثر قدرة على التميه من الأملاح (CHCl , BHCl , AHCl)
- تركيز [AH+] لمحلول القاعدة A أكبر من [CH+] لمحلول القاعدة C
9- محلول القاعدة الأعلى تأيناً في الماء:
أ- A
ب- B
ج- C
د- D
10- محلول الملح الذي يكون له تركيز [H3O+] الأقل عند تساوي تراكيز الأملاح:
أ- AHCl
ب- BHCl
ج- CHCl
د- DHCl
11- ينتج عند تفاعل الحمض المرافق للقاعدة الأضعف مع الماء:
أ- A + H3O+
ب- D + H3O+
ج- CH+ + OH-
د- BH+ + OH-
12- محلول الحمض HCl تركيزه (0.05 M)، فإن تركيز [OH-] (M) يساوي: (Kw = 1 x 10-14)
أ- 1 x 10-13
ب- 2 x 10-13
ج- 5 x 10-12
د- 5 x 10-13
 يمثل الجدول المجاور محاليل أملاح متساوية التركيز (0.1 M) لحموض ضعيفة ومعلومات عنها، ادرسه، ثم أجب عن الفقرات (13،14،15)، علماً بأن (Kw = 1 x 10-14 , log 2 = 0.3).
يمثل الجدول المجاور محاليل أملاح متساوية التركيز (0.1 M) لحموض ضعيفة ومعلومات عنها، ادرسه، ثم أجب عن الفقرات (13،14،15)، علماً بأن (Kw = 1 x 10-14 , log 2 = 0.3).
13- الترتيب الصحيح للحموض وفقاً لقوتها:
أ- CH3COOH < HOCl < HNO2
ب- HOCl < CH3COOH < HNO2
ج- HNO2 < CH3COOH < HOCl
د- CH3COOH < HNO2 < HOCl
14- أيون الملح الأكثر قدرة على التفاعل مع الماء:
أ- K+
ب- NO2-
ج- CH3COO-
د- ClO-
15- صيغة الأيون المشترك عند إضافة بلورات الملح CH3COOK إلى محلول الحمض CH3COOH :
أ- CH3COO-
ب- K+
ج- CH3COOH
د- OH-
إعداد : شبكة منهاجي التعليمية
13 / 06 / 2023
النقاشات